Pobieranie materiału do badań laboratoryjnych
POBIERANIE KRWI

Przygotowanie pacjenta:
- zwierzę przez kilka dni poprzedzających badanie powinno zachowywać dotychczasową dietę,
- krew powinna być pobrana przed leczeniem lub po ewentualnym odstawieniu leków mogących wpływać na poziom mierzonego składnika (o ile nie zaburza to procesu terapeutycznego).
- w miarę możliwości zwierzę powinno być na czczo (8-12 godzin od ostatniego karmienia).
! Brak głodówki powoduje zafałszowanie wyników m.in. dla glukozy, cholesterolu, trójglicerydów, ALT, AST, alfa-amylazy, bilirubiny, białka całkowitego, leukocytów i Ca.
- przed pobieraniem krwi pacjent nie powinien być silnie przestraszony oraz nie powinien wykonywać żadnego wysiłku fizycznego, wskazany jest co najmniej kilkuminutowy odpoczynek.
! Umiarkowany wysiłek fizyczny powoduje spadek wartości: glukozy, cholesterolu i trójglicerydów. Znaczny wysiłek fizyczny powoduje wzrost wartości białka całkowitego, kreatyniny, fosforu, AST i glukozy.
Probówki do preparowania krwi do badań (Medlab Products):
Kolor nakrętki: | Materiał dodany: | Rodzaj próbki: | Zastosowanie: |
Dodatkowe informacje: |
czerwony | Granulat do naturalnego wykrzepiania krwi | Surowica | Chemia kliniczna | Nie wymaga mieszania po pobraniu |
jasnofioletowy
| Antykoagulant: wersenian dwupotasowy (EDTA-K2) | Krew pełna wersenianowa | Morfologia krwi, ocena rozmazu krwi | Delikatnie wymieszać po pobraniu |
czarny | Roztwór 3,8% cytrynianu sodu | Krew pełna cytrynianowa | OB | Delikatnie wymieszać po pobraniu |
jasnoniebieski | 3,2% roztwór dwuwodnego cytrynianu sodu | Osocze cytrynianowe | Badanie układu krzepnięcia | Delikatnie wymieszać po pobraniu |
Zalecana kolejność pobierania krwi do poszczególnych probówek:
- Krew na posiew
- OB
- Koagulologia
- Morfologia
- Skrzep
Krew do badania morfologicznego:
- starać się ucisnąć żyłę na krótko przed pobraniem (hemoliza),
- unikać stosowania zbyt dużego podciśnienia w strzykawce, aby zapobiec pękaniu erytrocytów,
- krew należy pobrać do próbówki z antykoagulantem (EDTA-K2; fioletowy korek),
- krew powinna być pobrana do wysokości kreski zaznaczonej przez producenta na probówce,
- przy pobieraniu krwi nie brać pierwszych kropli, gdyż zawierają one duże stężenie czynników krzepnięcia, krew musi spływać po ściance, nie powinna kapać, ani płynąć zbyt silnym strumieniem – powstawanie piany i hemoliza,
- po zamknięciu probówki korkiem, zawartość należy starannie wymieszać poprzez delikatne kołysanie. Przy mieszaniu należy unikać pienienia się krwi powodującego hemolizę oraz nieprawidłowe wymieszanie z antykoagulantem i w efekcie powstanie skrzepu,
- krew pełna powinna być dostarczona do laboratorium w czasie nie dłuższym niż 4 godziny od pobrania. Do momentu wysłania krew powinna być przechowywana w lodówce w temperaturze 4oC.
Krew na „rozmaz” (leukogram, pasożyty krwi):
- pobieramy do probówki z EDTA (postępujemy tak jak w przypadku pobierania krwi do badania morfologicznego); jeśli nie jest możliwe szybkie dostarczenie krwi do laboratorium (do 4 godzin) należy samodzielnie wykonać rozmaz krwi nakrapiając kroplę krwi na szkiełko podstawowe i rozmazując ją przy pomocy drugiego szkiełka, ciągnąc kroplę krwi za szkiełkiem,
- rozmaz powinien być równomierny i bez przerw, a na końcu stawać się coraz cieńszy
- rozmaz należy pozostawić do wyschnięcia na powietrzu
Krew do oznaczeń biochemicznych („na skrzep”):
- w celu uzyskania surowicy krew powinna być pobrana do probówki bez dodatku antykoagulantów (czerwony korek) lub do ependorfów.
- po pobraniu krwi probówka powinna zostać ustawiona w pionie, w temp. pokojowej do czasu uzyskania skrzepu (ok. 20-30 min),
- jeżeli krew po pobraniu nie może być w ciągu 2 godzin dostarczona do laboratorium, wtedy próbkę należy odwirować na miejscu, a do badań przesłać surowicę (uzyskaną poprzez odwirowanie krwi przez 5-10 min przy 3500 obr/min). Surowica w większości wypadków może być następnie przechowywana w lodówce nawet przez 24 godziny.
- w przypadku oznaczania składników lipidowych oznaczenie powinno nastąpić maksymalnie do 2 godzin od pobrania krwi,
- w przypadku oznaczania bilirubina należy krew chronić przed światłem,
- w przypadku oznaczeń fosforu i glukozy należy jak najszybciej oddzielić surowicę.
- w przypadku oznaczenia mocznika- surowica może być przechowywana do 48 godz. w temperaturze pokojowej.
Czynniki utrudniające analizę:
Czynnik wpływający na wynik badania | Rodzaj zmiany | Parametr |
hemoliza | Wzrost wartości | AST, ALT, P, K, kreatynina, Mg, Fe ALP, bilirubina, albuminy, glukoza, |
lipemia | Wzrost wartości | ALT, AST, ALP, Ca, bilirubina, cholesterol, trójglicerydy, białko całkowite, glukoza, kreatynina, hemoglobina |
Spadek wartości | Amylaza, albuminy, K, Na | |
żółtaczka | Wzrost wartości | ALP, Białko całkowite |
Spadek wartości | Trójglicerydy, kreatynina, MG |
Krew do badania OB:
- krew należy pobrać do próbówki z 3,2% cytrynianem sodowym (czarny korek),
- po pobraniu zawartość probówki należy delikatnie wymieszać,
- do badania potrzebne jest minimum 1 ml krwi.
Badanie krwi w kierunku FeLV/FIV:
- surowica i osocze mogą być świeże bądź przetrzymywane w lodówce do 7 dni lub w zamrażarce powyżej 7 dni ,
- krew pełną należy pobrać na EDTA lub heparynę i użyć świeżą bądź schłodzoną (2-7 ºC max 7 dni),
- hemoliza, lipemia, EDTA i heparyna nie wpływają na wynik.
Osocze do badań układu krzepnięcia:
- Badanie układu hemostazy wykonuje się w osoczu uzyskanym drogą odwirowania pełnej krwi żylnej, pobranej na 3,2% cytrynian sodu (probówka z niebieskim korkiem), dokładnie w stosunku 1:10,
- odpowiedni poziom napełnienia probówki zaznaczony jest na nalepce. Brak odpowiednich proporcji w poważnym stopniu zaburza wynik badania!
- nie należy stosować opaski uciskowej, żyłę zacisnąć ostrożnie i na krótko do 30 sek.
- jeśli czas dostarczenia materiału do laboratorium będzie przekraczał 2 godziny od pobrania, to bezpośrednio po pobraniu należy poddać krew wirowaniu (5 min, przy 3500 obr/min.), przenieść uzyskane osocze do czystej probówki (osocze można przechowywać do 8 godzin w lodówce).
POBIERANIE WŁOSÓW I ZESKROBIN DO BADANIA MIKOLOGICZNEGO:
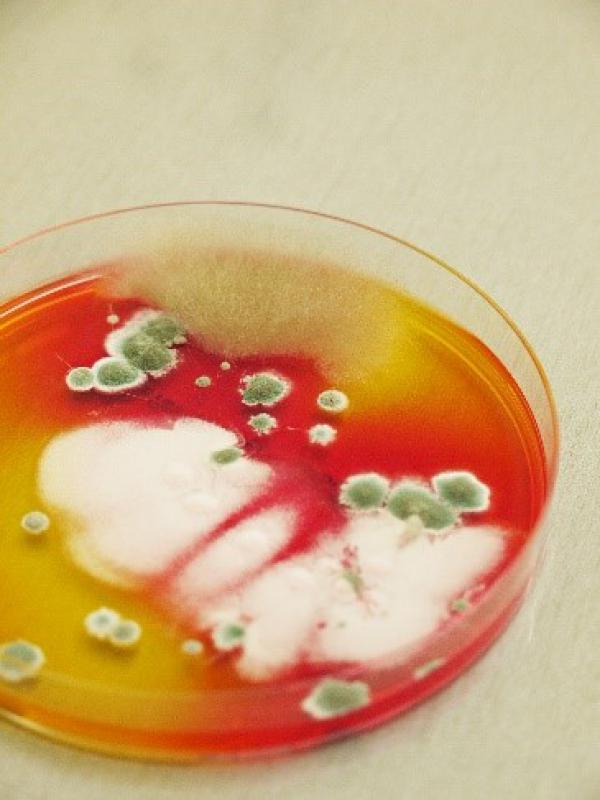
- Materiał powinien być pobrany przed rozpoczęciem terapii przeciwgrzybiczej lub co najmniej 4 tygodni od momentu zakończenia leczenia,
- w celu izolacji dermatofitów zalecana jest wcześniejsza dezynfekcja badanego miejsca za pomocą 70% alkoholu,
- należy wyrwać kilkanaście włosów wraz z cebulkami z obrzeża zmian i/lub zeskrobać, np. skalpelem naskórek bez naruszania ciągłości skóry. Włosy obcięte nożyczkami nie nadają się do badania,
- materiał (wraz ze skalpelem) umieścić w jałowym, zamykanym pojemniku,
- zeskrobiny możemy przechowywać do 72 godzin w temperaturze pokojowej,
- przy pobieraniu materiału do hodowli grzybów drożdżopodobnych i pleśniowych należy postępować taj jak przy pobieraniu materiału do badania bakteriologicznego.
POBIERANIE MATERIAŁU DO BADAŃ BAKTERIOLOGICZNYCH:

- Materiał do badań bakteriologicznych należy pobierać we wczesnym okresie choroby, przed podaniem choremu antybiotyków lub co najmniej 4 dni po ich odstawieniu (kontrola skuteczności antybiotykoterapii). Pobieranie materiału zawierającego antybiotyk lub inny środek antyseptyczny może zafałszować wynik badania mikrobiologicznego, dając wynik fałszywie ujemny! Wymazy należy pobierać z miejsc zmienionych zapalnie lub pokrytych wydzieliną, unikając zanieczyszczenia próbki przez przypadkowe dotknięcie otoczenia, co mogłoby dać wynik fałszywie dodatni.
- Materiał powinien być natychmiast przekazany do laboratorium. Wyjątkami od tej zasady są: materiały pobrane na podłoża transportowe (AMIES, STUART), które mogą być przechowywane w temp. pokojowej przez 2-3 dni (jednak szybkie posianie materiału gwarantuje lepszą możliwość wyhodowania szczepów szczególnie wymagających) oraz materiały pobrane na podłoża hodowlane (mogą być do czasu transportu inkubowane w temp. 36oC lub w temperaturze pokojowej).
- Kał: Ze świeżo oddanego kału, łopatką przytwierdzoną do pokrywki pojemnika na kał pobrać próbkę kału wielkości orzecha włoskiego lub 2-3 ml płynnego kału. Próbkę przenieść do czystego, suchego, plastikowego pojemnika na kał, który jest szczelnie zamykany.
-materiał pobierać z różnych miejsc, ze szczególnym uwzględnieniem miejsc o zmienionym wyglądzie ( ropa, krew lub śluz),- jeśli pobieramy kał na podłoże transportowe należy zanurzyć wymazówkę z wacikiem w kale, a następnie przenieść ją do probówki z podłożem transportowym,- kał należy dostarczyć do laboratorium w ciągu 2 godzin, jeżeli jest to niemożliwe próbki należy transportować na podłożu transportowym.
- Wymazy z powierzchni suchych (np. skóra, błony śluzowe): pobieramy wymazówką, którą wcześniej nawilżamy w jałowym roztworze soli fizjologicznej.
- Wymaz z gardła: pobieramy w miarę możliwości na czczo, starając się nie dotknąć wymazówką języka i błony śluzowej policzka.
- Zmiany ropne: przed pobraniem ropy z umiejscowionych głębiej zmian należy odkazić skórę 70% etanolem, a następnie materiał pobrać za pomocą igły i strzykawki i umieścić w sterylnym pojemniku lub pozostawić w strzykawce z zatkaną igłą. W przypadku gdy ropy jest mało można pobrać materiał wymazówką po wcześniejszym nacięciu zmiany skalpelem.
- Wymazy z ran, owrzodzeń: pobrać po usunięciu zeschniętej wydzieliny i oczyszczeniu powierzchni jałową solą fizjologiczną. Wymaz pobrać z najgłębszego miejsca.
- Oko: pobieramy wymazy z worków spojówkowych obydwu oczu ( wymaz z oka zdrowego jest tu kontrolą). W przypadku suchych, złuszczających się zmian, materiał pobieramy jałową szpatułką lub skalpelem do jałowego pojemnika.
- Mocz: pobieramy do jałowego pojemnika . Jeśli nie jest możliwe szybkie dostarczenie moczu do laboratorium (do 4 godzin w temp. 4oC), mocz można posiać na podłoże transportowo–wzrostowe (np. Uromedium, Uriline, Uricult) zgodnie z instrukcją producenta i dostarczyć do laboratorium w ciągu 24 godzin.
- Uszy: przed rozpoczęciem pobierania materiału skórę ucha należy oczyścić tamponem nasączonym 70% alkoholem etylowym. Następnie z miejsc zmienionych chorobowo pobieramy materiał jałową wymazówką (osobno dla każdego ucha-zdrowe ucho stanowi kontrolę). Należy pamiętać że materiał pobrany z ucha zewnętrznego zawiera florę fizjologiczną, dlatego przy braku objawów uszkodzenia skóry, zalecane jest pobranie materiału po nakłuciu błony bębenkowej.
POBIERANIE KAŁU DO BADANIA PARAZYTOLOGICZNEGO:
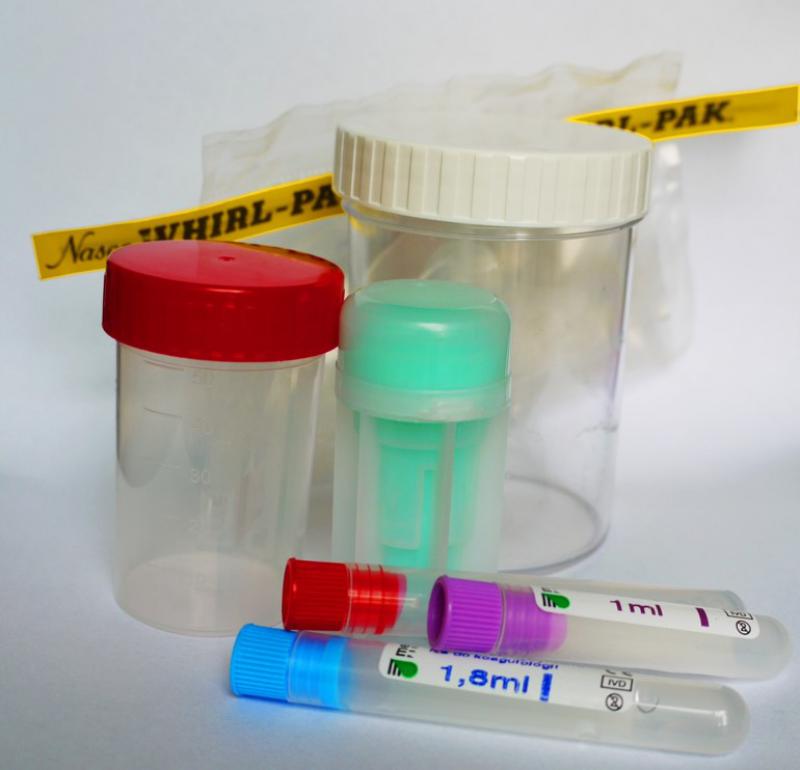
- Próbkę do badania należy pobrać z kilku miejsc oddanego kału i umieścić w czystym, szczelnie zamykanym pojemniku.
- Próbki powinny być dostarczone do laboratorium jak najszybciej po pobraniu, do tego czasu zaleca się przechowywanie materiału w lodówce.
- Przy podejrzeniu lambliozy kał musi być badany ,,na ciepło” (jak najszybciej po oddaniu stolca).
POBIERANIE ZESKROBIN ZE SKÓRY (BADANIE PARAZYTOLOGICZNE):
- zeskrobinę pobiera się za pomocą szpatułki laboratoryjnej lub stępionego skalpela,
- najlepiej jest pobierać materiał z różnych miejsc oraz z różnych warstw skóry zarówno z miejsc zmienionych chorobowo jak i na granicy ze zdrowymi fragmentami skóry,
- aby ułatwić pobieranie próbek skórę i/lub narzędzia do pobierania zeskrobin można zwilżyć olejem mineralnym. U ras zwierząt o długiej sierści, obszar z którego pobiera się zeskrobinę powinien zostać delikatnie wygolony,
- w przypadku podejrzenia nużeńców (Demodex sp.) zalecane jest ściśnięcie skóry przed lub w trakcie pobierania zeskrobin, aby spowodować wychodzenie nużeńców z mieszków włosowych. Zeskrobina powinna być na tyle głęboka, aby pojawiło się krwawienie z naczyń włosowatych.
POBIERANIE MOCZU:
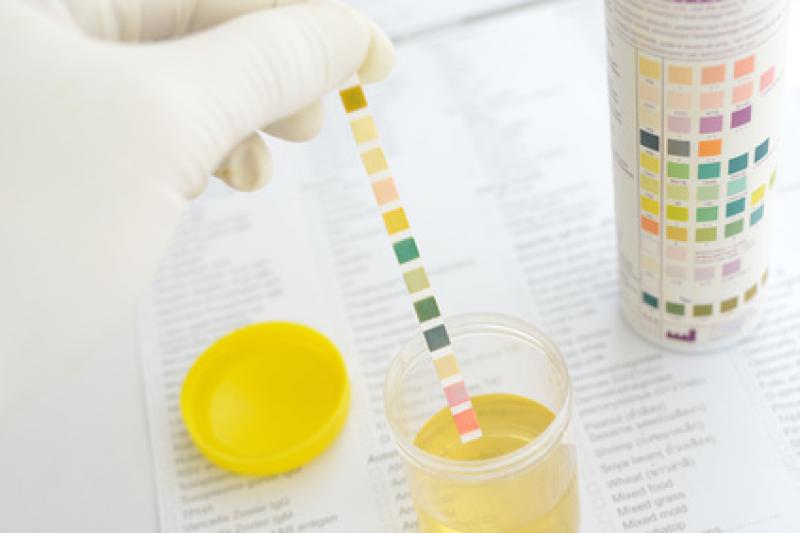
- Mocz powinien być pobrany przed leczeniem, lub po ewentualnym odstawieniu leków mogących wpływać na poziom mierzonego składnika (o ile nie zaburza to procesu terapeutycznego).
- Mocz powinien być pobrany do sterylnego, czystego pojemnika, w ilości minimum 10 ml (zalecana ilość to 50 ml).
- Preferuje się mocz uzyskany poprzez cystocentezę, można też cewnikować pęcherz moczowy bądź pobrać ze środkowego strumienia moczu podczas mikcji
